Psoriasis Arthritis im klinischen Alltag
Klinische Daten zeigen, dass der PDE4-Inhibitor Apremilast, insbesondere bei moderater Psoriasis Arthritis (PsA), auch in der Langzeittherapie über 5 Jahre effektiv und gut verträglich ist. Eine nicht interventionelle Studie bestätigt diese Ergebnisse auch unter Praxisbedingungen.
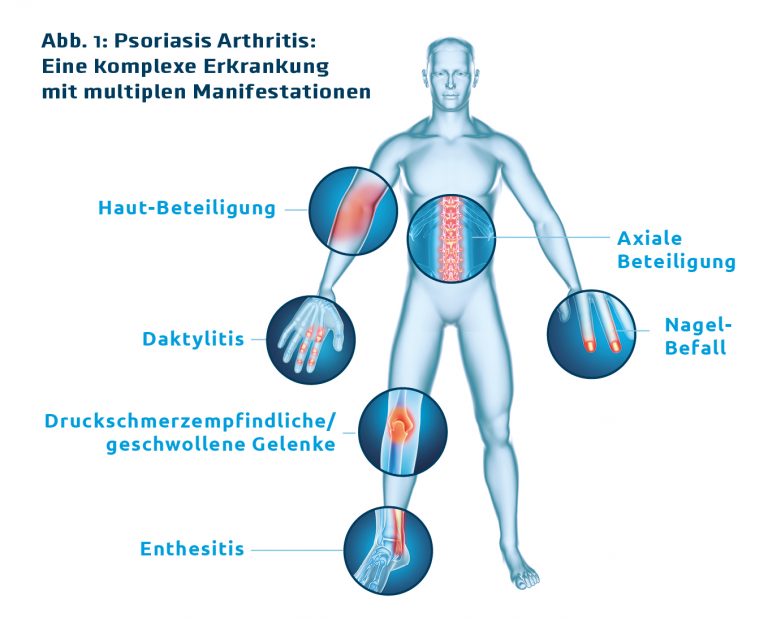
Die PsA ist, betreffend die Zahl der betroffenen Gelenke und die Schwere der Symptome, eine heterogene Erkrankung. Dabei kann das klinische Erscheinungsbild von oligoartikuärem Befall mit weniger als 5 betroffenen Gelenken bis hin zur Polyarthritis reichen. Darüber hinaus können auch extraartikuläre Manifestationen wie Daktylitis und Enthesitis sowie die Beteiligung von Haut und Nägeln stark variieren. „Diese Heterogenität macht das leitliniengerechte Vorgehen so schwierig, da es eigentlich für jeden Patienten eine eigene Leitlinie bräuchte“, sagt Prof. Frank Behrens, CIRI/Rheumatologie & Fraunhofer Institut Translationale Medizin und Pharmakologie an der Goethe-Universität, Frankfurt/Main.
Während in klinischen Studien vorwiegend Patienten mit schwerer, polyartikulärer PsA inkludiert werden, weist rund die Hälfte der Patienten im klinischen Alltag eine oligoartikuläre PsA mit moderater Aktivität auf.1,2 Extraartikuläre Manifestationen treten bereits früh im Krankheitsverlauf auf. So hat eine Studie gezeigt, dass 25% der PsA-Patienten mit einer Erkrankungsdauer von weniger als 2 Jahren und durchschnittlich 4 betroffenen Gelenken an Enthesitis und 41,9% an Daktylitis leiden, und dass bei einem überwiegenden Teil von 81,5% auch die kleineren, peripheren Gelenke betroffen sind.3
Oligoarthritis und Lebensqualität
Die Daten der Arbeitsgruppe der Regionalen Kooperativen Rheumazentren weisen darüber hinaus darauf hin, dass die Krankheitslast für Patienten mit Oligoarthritis oft über jener von Patienten mit Polyarthritis liegt.4 Demnach weisen 63,6% der Patienten mit Oligoarthritis Osteoproliferationen auf, während dies bei Patienten mit Polyarthritis nur bei 43,2% der Fall ist. Auch sind Komorbiditäten wie Nierenerkrankungen, Herzkrankheiten, Diabetes, Osteoporose und Osteoarthritis bei oligoartikulärer PsA häufiger als bei polyartikulärem Phänotyp (82,8% vs. 68,3%). Die gleiche Untersuchung kam auch zu dem Ergebnis, dass die oligoartikuläre PsA häufiger mit Schlafstörungen, Fatigue, Schmerz und einer allgemeinen Einschränkung der Lebensqualität assoziiert ist, als die polyartikuläre PsA. Dass die Oligoarthritis die Lebensqualität der PsA-Patienten zumindest ebenso stark einschränkt wie die Polyarthritis war auch das Ergebnis einer niederländischen Studie.5 Dabei spielten die nicht artikulären, muskuloskelettalen Manifestationen, insbesondere die Enthesitis, eine wesentliche Rolle für die Senkung der Lebensqualität.
Sinnvolle Therapieoption
In einer rezent publizierten, groß angelegten skandinavischen Befragung von mehr als 1.254 Patienten mit schwerer Psoriasis (PsO) bzw. PsA stellte sich heraus, dass ein signifikanter Anteil mit ihrer Therapie nicht zufrieden ist.6 Es zeigte sich, dass nur etwa die Hälfte der Patienten mit PsA mit oder ohne PsO eine orale oder subkutan applizierte Therapie inklusive Methotrexat verordnet bekam. Biologika erhielten in diesem Patientenkollektiv nur rund 40%. Zufrieden mit der Medikation war rund ein Drittel der Patienten, die Methotrexat bzw. knapp 60%, die ein Biologikum erhalten hatten. Hauptgründe für die Unzufriedenheit mit Methotrexat waren Nebenwirkungen (60,2%), gefolgt von geringer Wirksamkeit (24,5%). Bei Biologika wurden fehlende Effektivität (28,9%) und Nebenwirkungen (28,1%) als wesentlichste Gründe für die Unzufriedenheit genannt.
Für den PDE4-Inhibitor Apremilast liegen Daten vor, wonach insbesondere Patienten mit moderater PsA auf die Therapie ansprechen.7 So erreichten 46,9% der Patienten mit moderater PsA nach 52 Wochenmdas Therapieziel geringe Krankheitsaktivität (LDA, low Disease activity) bzw. Remission. „Auch bei Patienten mit moderater Enthesitis geht die Krankheitsaktivität nach einem Jahr Therapie mit Apremilast gegen Null, sodass wir sagen können: Wir haben hier eine sinnvolle Therapieoption für Patienten mit moderater PsA“, berichtet Behrens.
Laut dem Experten stellen die ACR-Kriterien kein geeignetes Instrument zur Findung der optimalen Therapie für PsA-Patienten dar, weshalb eine Arbeitsgruppe des Fraunhofer Instituts an einem Algorithmus mit dem Titel „best matching therapy“ arbeitet, in den einerseits die Krankheitsmanifestationen und andererseits die Wirksamkeit der verschiedenen Therapeutika einfließen, um zu einer optimalen, individuellen Therapieentscheidung zu kommen.
Langzeitevidenz zu Apremilast
Im klinischen Studienprogramm PALACE (Psoriatic Arthritis Long-term Assessment of Clinical Efficacy) 1 - 3 konnte die breite Wirksamkeit hinsichtlich der relevanten Krankheitsmanifestationen von Apremilast nachgewiesen werden.8,9,10 Insgesamt nahmen 1.493 systemisch vorbehandelte Patienten mit einer seit mindestens sechs Monaten bestehenden PsA an den PALACE-Studien teil. Einschlusskriterien waren zumindest drei geschwollene und drei druckschmerzhafte Gelenke trotz Vortherapie mit einem csDMARD oder einem TNF-Blocker. Die Patienten wurden 1:1:1 randomisiert und erhielten entweder Apremilast 2x20 mg/d, die zugelassene Apremilast-Dosierung von 2x30 mg/d oder Placebo. Die verblindete aktive Behandlungsphase wurde auf insgesamt 52 Wochen ausgedehnt. Mittlerweile liegen auch die Daten der offenen Langzeitbeobachtung über 5 Jahre vor. Eingeschlossen waren Patienten, die bereits mit krankheitsmodifizierenden Medikamenten (DMARDs) inklusive Biologika vorbehandelt waren.
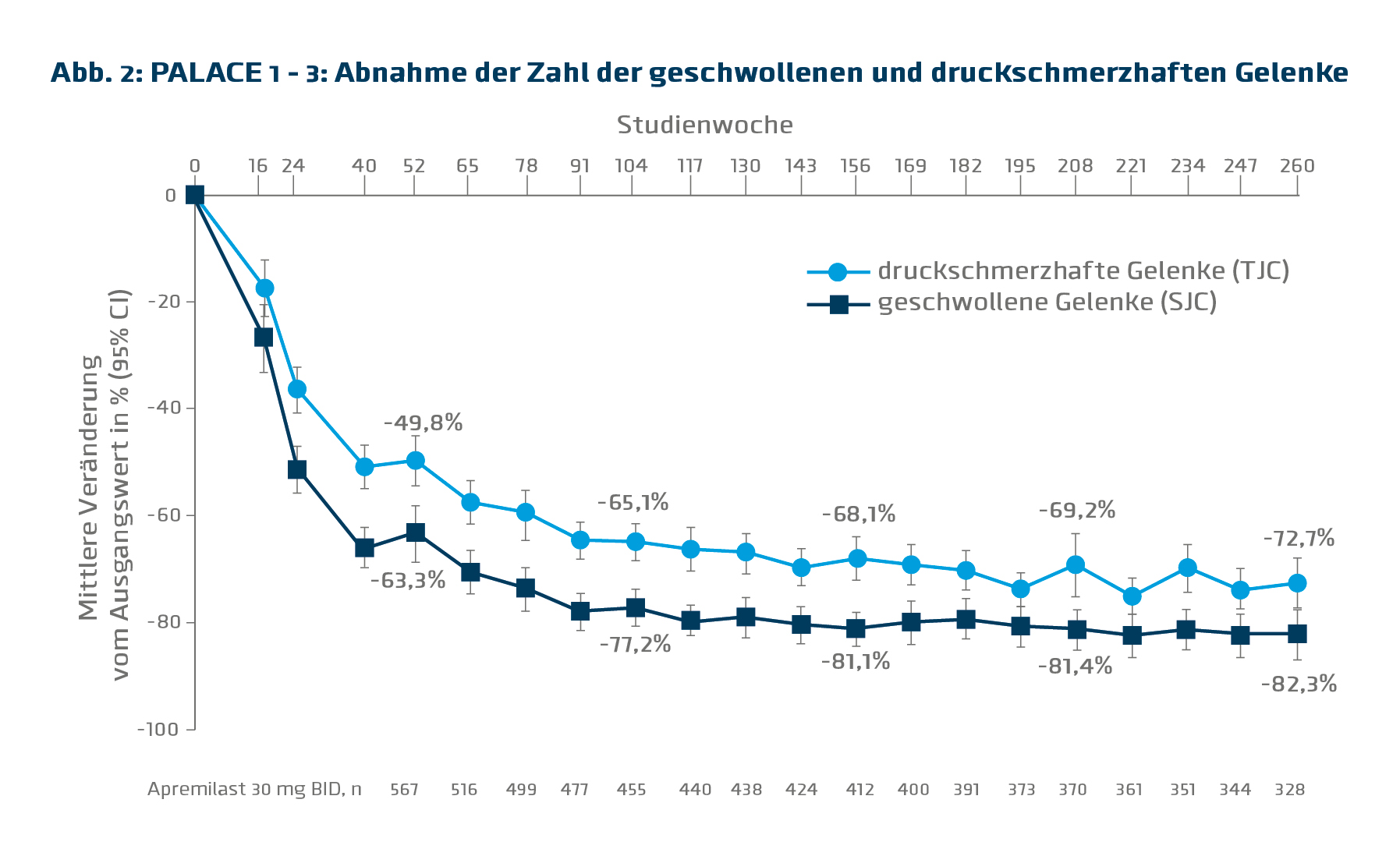
Die 5-Jahresdaten der PALACE-Studien zeigen, dass die mittlere Anzahl an geschwollenen ebenso wie druckschmerzhaften Gelenken bis zum 2. Jahr der Therapie mit Apremilast 2x30 mg/d signifikant abnimmt und in weiterer Folge bei abnehmender Patientenzahl bis zum Jahr 5 konstant niedrig bleibt (Abb. 2).11 „Das zeigt uns, dass Apremilast einen raschen Effekt hat, der noch einige Zeit benötigt, um seine volle Wirkung zu entfalten. Danach können wir weiterhin mit einem stabilen Ansprechen rechnen“, berichtet Prof. Jürgen Wollenhaupt, Abt. f. Rheumatologie an der Schönklinik in Hamburg Eilbek. Eine vergleichbare Wirkung von Apremilast wurde auch in Bezug auf Enthesitis und Daktylitis beobachtet. So erreichten nach 5 Jahren 80,9% der Patienten einen Daktylitis Count von 0 und 62,2% einen MASES von 0, was eine vollständige Symptomfreiheit bezüglich Enthesitis bzw. Daktylitis bedeutet. Mit 65,8% der Patienten, die nach 5 Jahren ein PASI 50- und 43,6%, die ein PASI 75-Ansprechen erreichten, zeigte Apremilast auch gute Wirkung auf die Haut. Der PDE 4-Inhibitor erwies sich über den Zeitraum von 5 Jahren als sicher und gut verträglich.
Apremilast bei Biologika-naiven Patienten
In der ACTIVE (Assessing Apremilast Monotherapy in a Clinical Trial of Biologic-naive Patients)-Studie wurde die Wirksamkeit von Apremilast in der Monotherapie bei Biologika-naiven-Patienten mit kürzerer Erkrankungsdauer evaluiert.12 Die Therapie mit Apremilast führte bei diesen Patienten bereits nach 2 Wochen zu einer raschenmund kontinuierlichen – Placebo signifikant überlegenen –Verbesserung im DAS (Disease Activity Score)-28. Nach 16 Wochen war die Zahl der geschwollenen Gelenke um 46,6% und nach 52 Wochen um 77,5% reduziert. Bezüglich der druckschmerzhaften Gelenke betrug die Reduktion nach 16 Wochen 32,3% und nach einem Jahr 70,4%. Ein ähnlicher Verlauf mit rascher und anhaltender Besserung wurde auch in Bezug auf die Enthesitis beobachtet.
Auch bezüglich der sekundären Endpunkte erwies sich Apremilast als effektiv. So sprachen 70,5% der Patienten mit Kopfhautpsoriasis gut auf die Behandlung an (ScPGA 0 oder 1), ebenso wie 88,0% der Patienten mit palmoplantarer Psoriasis (PPGA 0 oder 1). 48% hatten einen NAPSI-Wert von 0. Pinter schließt aus diesen Daten, dass Apremilast auch in „Real-World“-Studien bei Patienten mit moderater Plaque-Psoriasis und belastenden Manifestationen gute Effekte zeigt.
Apremilast unter Praxisbedingungen
Die LAPIS-PsA (Langzeitdokumentation zur Anwendung von Apremilast bei Patienten mit Psoriasis Arthritis unter Praxisbedingungen) ist eine nicht interventionelle Studie (NIS), in der die Effektivität von Apremilast unter Praxisbedingungen evaluiert wird, wobei auch die Beurteilung der Wirkung durch Ärzte (PGA, Physician Global Assessment) und Patienten (PtGA, Patient Global Assessment) erfasst wird.13 LAPIS-PsA ist derzeit noch am Laufen.
Die Interimsanalyse nach 7 Monaten zeigt, dass nach diesem Zeitraum 77% der Patienten einen PGA von 0 oder 1 hatten, was Patienten keine oder nur minimale Symptome bedeutet. 60% der Studienteilnehmer mit Enthesitis und 72% mit Daktylitis waren nach 7 Monaten symptomfrei. Auch bezüglich druckschmerzhafter und geschwollener Gelenke konnte ein massiver Abfall (-57,1% bzw. -60,0%) beobachtet werden und die Hautsymptomatik verbesserte sich in diesem Zeitraum um ca. 70%. Entsprechend den Verbesserungen der klinischen Parameter kam es auch zu einer Reduktion der Belastung durch die Erkrankung. Die gute Verträglichkeit von Apremilast konnte auch in dieser NIS unter Praxisbedingungen nachgewiesen werden.
Referenzen:
- Wilson FC et al., J Rheumatol. 2009;36(2):361-7.
- Lindqvist UR et al., J Rheumatol. 2008;35(4):668-73.
- Queiro R et al., Arthritis Rheum. 2017; 69(S10):abstract 2526.
- Huscher D et al., Abstract. ACR/ARHP Annual Meeting, San Francisco, CA, USA, 6-11 November 2015.
- Wervers K et l., J Rheumatol. 2018;45(11):1526-1531.
- Tveit KS et al., J Eur Acad Dermatol Venereol. 2019;33(2):340-354.
- Mease PJ et al., Poster. ACR/ARHP Annual Meeting, Chicago, IL, USA, 19.-24. Oktober 2018.
- Kavanaugh M et al., J Rheumatol. 2015;42(3):479-88.
- Cutolo M e al., J Rheumatol. 2016;43(9):1724–1734.
- Edwards CJ et al., Ann Rheum Dis. 2016;75(6):1065–1073.
- Kavanaugh M et al., Arthritis Res Ther. 2019 10;21(1):118.
- Nash P et al., Ann Rheum Dis. 2018;77(5):690-698.
- Wollenhaupt J et al., DGRh 2019, Dresden, 04.-07. September 2019; Celgene Data on file EULAR 2018, Amsterdam, NL, 13. - 16. Juni 2018; Celgene Data on file