3. Morbus Behçet: Therapie mit Apremilast
In einer großen multinationalen Phase-3-Studie wurde gezeigt, dass Apremilast die Zahl oraler Ulzera – eines Kardinalsymptoms von Morbus Behçet – signifikant reduziert und die Lebensqualität der Betroffenen steigert. Bei mehr als 50% der Patienten verschwanden die oralen Ulzera sogar ganz. Langzeitdaten bestätigen die Ergebnisse.
Ende April 2020 wurde die Indikation von Apremilast (
Otezla®) erweitert. Der PDE-4-Inhibitor darf nun auch „zur Behandlung von erwachsenen Patienten mit oralen Aphthen, die mit dem Behçet-Syndrom assoziiert sind und für die eine systemische Therapie in Frage kommt“, verwendet werden
1.
RELIEF: Die Zulassungsstudie
Als Basis dieser Zulassungserweiterung diente die RELIEF-Studie, die 2019 im renommierten „New England Journal of Medicine“ publiziert wurde 2. Dies war die erste groß angelegte internationale klinische Studie, in der die langfristige Wirkung einer Behandlung des M. Behçet evaluiert wurde. Schubweise auftretende, rezidivierende orale Ulzera können die Erstmanifestation eines M. Behçet sein 3. Sie treten bei fast allen Behçet-Patienten (98,5%) auf 4. Orale Ulzera sind zumeist schmerzhaft, erschweren alltägliche Tätigkeiten wie Sprechen, Essen oder Trinken und schränken damit die Lebensqualität erheblich ein 5. Bisherige Therapieansätze für dieses Problem waren wenig erfolgreich 6. Das Rationale für den Einsatz des small molecules Apremilast für die Therapie oraler Ulzera bei M. Behçet ist seine Fähigkeit, proinflammatorische Signalkaskaden zu modulieren 2. Konkrete Zytokine, die bei Behçet-Syndrom hinaufreguliert sind und auf die Apremilast modulierend wirkt, umfassen TNF-α, IL-2, IL-8, IL-12, IL-17 und INF-γ 2.
Studiendesign
RELIEF war eine randomisierte, plazebokontrollierte, doppelblinde Phase-3-Studie, die in 53 Zentren in zehn Ländern (Asien, Europa, Nordamerika, Israel, Libanon und Türkei) durchgeführt wurde. Die Teilnehmer waren mindestens 18 Jahre alt und hatten aktive orale Ulzera, die in den vergangenen zwölf Monaten mindestens dreimal aufgetreten waren, obwohl die Patienten mindestens ein nicht-biologisches Medikament verwendet hatten. Dazu zählten topische oder systemische Kortikosteroide, NSAR, Colchicin, Immunsuppressiva und Thalidomid.
Ausschlusskriterien waren schwere Organbeteiligungen, die eine systemische Behandlung erforderten, vaskuläre oder ZNS-Beteiligung in den letzten zwölf Monaten, weiters die anamnestische Verwendung eines Biologikums gegen orale Ulzera sowie das Bestehen anderer klinisch signifikanter Erkrankungen (z.B. Infektionen, maligne Erkrankungen, stärkere Laborveränderungen oder psychiatrische Erkrankungen). Hingegen konnten Patienten mit Haut- oder Gelenksmanifestationen des M. Behçet an der Studie teilnehmen.
Die Patienten wurden nach einer bis zu sechs Wochen dauernden Screeningphase im Verhältnis 1:1 randomisiert und zwölf Wochen lang entweder mit 2x 30mg Apremilast oder Plazebo behandelt. Nach Ende der zwölf Wochen wurde allen Patienten die Teilnahme an einer 52 Wochen dauernden Verlängerungsstudie angeboten, in der sämtliche Teilnehmer mit Apremilast behandelt wurden. Nach Behandlungsende wurden die Teilnehmer weitere vier Wochen lang nachbeobachtet.
Primärer Endpunkt war die Fläche unter der Kurve (AUC), die sich aus der Zahl der Ulzera und der Zeit ergab. Dabei wurden die Ulzera zu Woche 0, 1, 2, 4, 6, 8, 10 und 12 beurteilt. Dieser Endpunkt wurde deshalb gewählt, weil er die rezidivierende Natur der Ulzera bei M. Behçet am besten erfasst. Es gab eine Reihe sekundärer Endpunkte, u.a. komplettes Ansprechen (d.h. Verschwinden) der Ulzera, Schmerz, Krankheitsaktivität und Lebensqualität.
Ergebnisse
207 Patienten wurden randomisiert, 179 beendeten die zwölf Wochen des ersten Studienteils (96 unter Apremilast, 83 unter Plazebo). Die AUC von Ulzera/Zeit betrug 129,5 unter Apremilast und 222,1 unter Plazebo (p<0,0001; Abb. 1) 2.
Abb. 1: Primärer Endpunkt der RELIEF-Studie
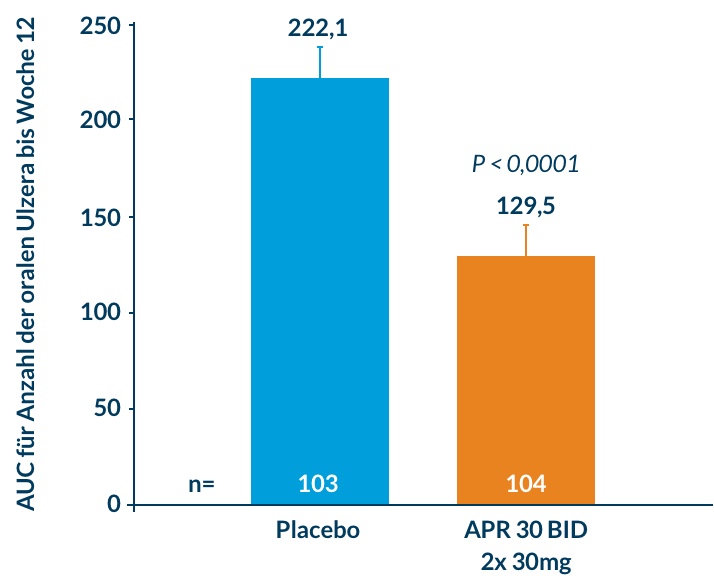
Abbildung 2 zeigt den Verlauf der Anzahl oraler Ulzera über die Zeit, einschließlich der Verlängerungsstudie.
Abb. 2: Verlauf der Anzahl oraler Ulzera
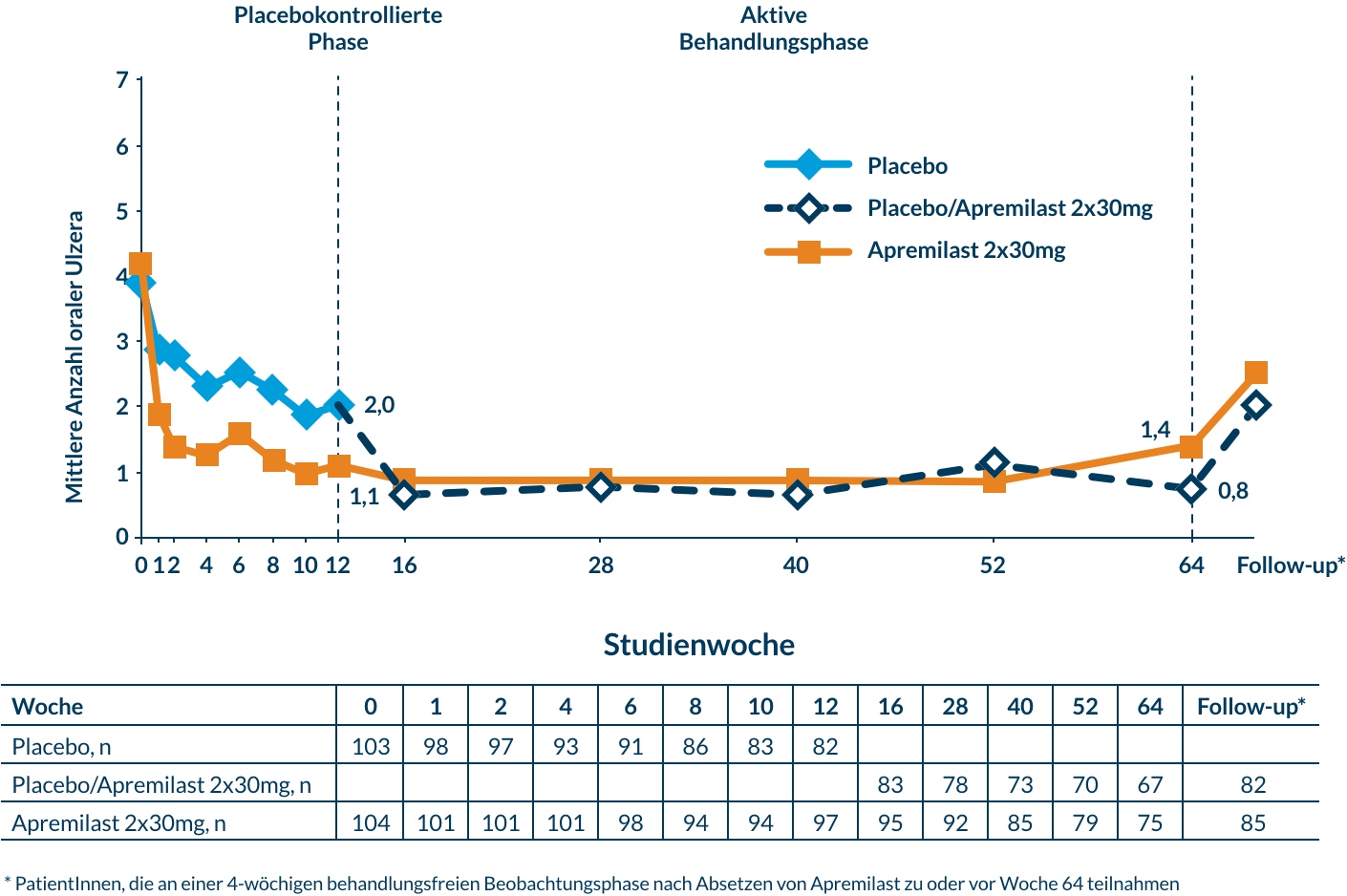
Das Ansprechen auf Apremilast erfolgte sehr schnell – bereits ab der ersten Behandlungswoche zeigte sich ein signifikanter Rückgang der oralen Ulzera (p≤0,0015) und der damit verbundenen Schmerzen (p≤0,0035) 7.
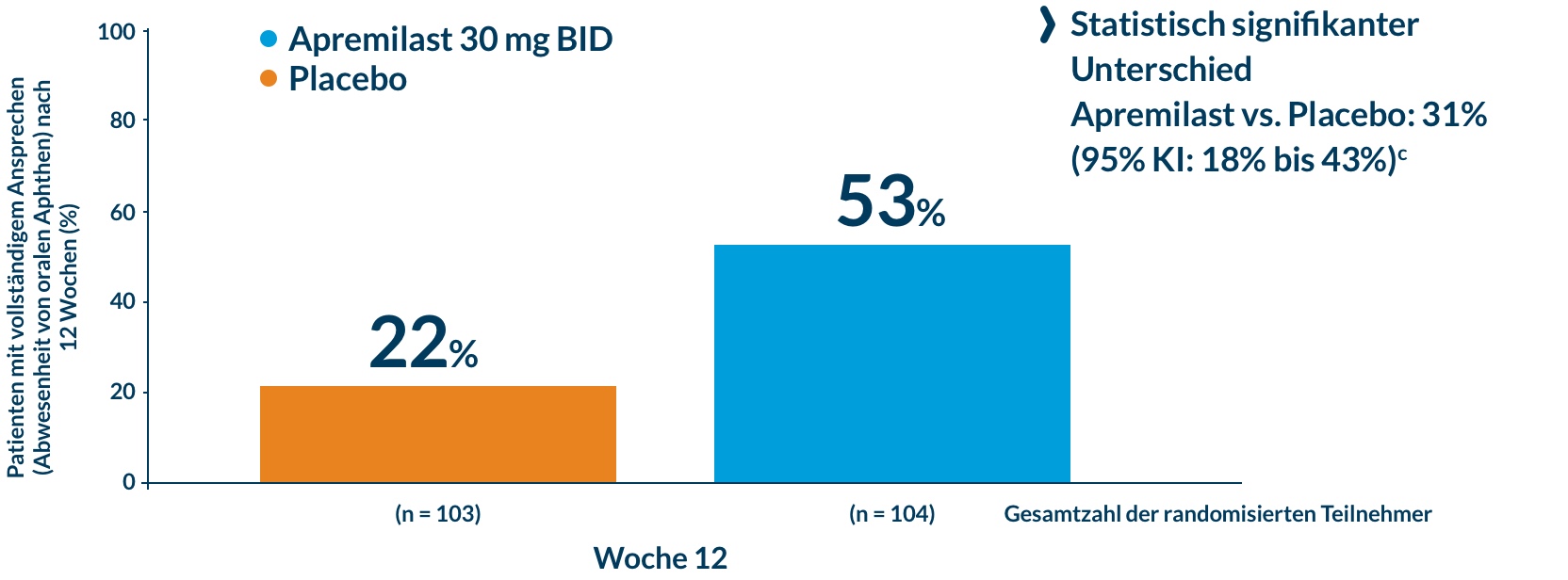
Die Rate der Patienten, die nach zwölf Wochen ein vollständiges Ansprechen (d.h. keine erkennbaren Ulzera mehr) zeigten, betrug unter Apremilast 53%, unter Plazebo nur 22% (Abb. 3) 2.
Abb. 3: Vollständiges Ansprechen nach 12 Wochen
Die Reduktion der oralen Ulzera in der RELIEF-Studie zog sich konsistent durch alle Subgruppen, etwa bei Stratifikation nach Krankheitsdauer, Anzahl der Ulzera, geographischer Region und anamnestischem Gebrauch von Colchicin und Glukokortikoiden. Verbesserungen durch Apremilast zeigten sich auch in einem Aktivitätsscore („Behçet’s Disease Current Activity Form“) 2.
Phase 2 bestätigt
RELIEF brachte die Bestätigung von Daten aus Phase 2. 111 Patienten mit M. Behçet und mindestens zwei oralen Ulzera wurden randomisiert und zwölf Wochen lang mit 2x 30mg Apremilast oder Plazebo behandelt. Auch hier folgte eine Verlängerungsphase, die in dem Fall ebenfalls zwölf Wochen dauerte; nach Behandlungsende gab es noch eine 28 Tage dauernde Beobachtungsphase.
Der primäre Endpunkt war in diesem Fall die Zahl der oralen Ulzera zu Woche 12. Sekundäre Endpunkte waren Schmerz (auf einer visuellen Analogskala, VAS, gemessen), die Anzahl genitaler Ulzera, die Gesamt-Krankheitsaktivität und die Lebensqualität.
Die Zahl der oralen Ulzera pro Patient betrug zu Woche 12 in der Apremilast-Gruppe 0,5±1,0 und in der Plazebogruppe 2,1±2,6 (p<0,001), ein signifikanter Unterschied.
Die Schmerzreduktion auf der VAS war unter dem PDE-4-Inhibitor mit minus 44,7 ±24,3 ebenfalls signifikant größer als in der Plazebo-Gruppe (minus 16,0 ±32,5; p<0,001) 8.
Klare Steigerung der Lebensqualität
Schon seit längerer Zeit ist klar, dass die Lebensqualität („Quality of Life“ – QoL) einen wesentlichen Beurteilungsparameter für den Erfolg einer Therapie darstellt. Das ist vor allem dort von Bedeutung, wo eine Erkrankung oder bestimmte Krankheitsmanifestationen die QoL erheblich einschränken, wie es etwa bei den oralen Ulzera im Rahmen des M. Behçet der Fall ist 9. Die gesundheitsbezogene Lebensqualität („Health-Related QoL“ oder HRQoL) ist auch signifikant mit dem Überleben assoziiert, wie mehrere Studien bei unterschiedlichen Populationen zeigten 10-12.
Für manche Erkrankungen, so auch für den M. Behçet, wurden eigene QoL-Scores entwickelt, in diesem Fall der „Behçet’s Disease Quality of Life Score“, der mögliche Resultate von 0 bis 30 Punkten aufweist, wobei höhere Punktezahlen eine schlechtere Lebensqualität bedeuten. Dieser Score wurde in der RELIEF-Studie verwendet. Es zeigte sich in der Apremilast-Gruppe eine Reduktion um 4,3 Punkte, in der Plazebo-Gruppe um 1,2 Punkte (der Ausgangswert in der Gesamt-Population der Studie lag bei 10,7 ± 8,2 Punkten). Somit war die QoL-Verbesserung unter Aprelimast größer als unter Plazebo. Die signifikanten Verbesserungen der Lebensqualität unter Apremilast konnten bei durchgehender Behandlung mit dem PDE-4-Inhibitor bis Woche 64 aufrechterhalten werden (p=0,0003) 13.
Sicherheit
Die Sicherheitspopulation von RELIEF umfasste 187 Patienten, von denen 107 mehr als ein Jahr lang Apremilast genommen hatten. 79% in der Apremilast-Gruppe und 72% in der Plazebo-Gruppe erlebten zumindest ein unerwünschtes Ereignis („Adverse Events“ – AE). Die häufigsten AE, die unter Apremilast öfter auftraten als unter Plazebo, waren Diarrhoe, Nausea, Kopfschmerzen und obere Atemwegsinfektionen (insbesondere viraler Genese) 2.
Update – Die 68-Wochen-Daten
Im Herbst 2021 wurden die 68-Wochen-Daten von RELIEF publiziert 14. 142 der ursprünglich 207 randomisierten Patienten beendeten die Studie nach 64 Wochen Therapie mit Apremilast und weiteren vier Wochen Nachbeobachtung.
Sowohl die Zahl der oralen Ulzera als auch Parameter wie Schmerz, Ansprechraten, Krankheitsaktivität und Lebensqualität, die zu Woche 12 unter Apremilast signifikant besser gewesen waren als unter Plazebo, waren bis Woche 64 konstant. Nach dem Absetzen von Apremilast zu Woche 64 stieg die Zahl der oralen Ulzera wieder an 14.
Dr. med. univ. Norbert Hasenöhrl
Literatur
- Veröffentlichte Fachinformation Otezla®.
- Hatemi, G et al.: Trial of Apremilast for Oral Ulcers in Behçet's Syndrome. N Engl J Med 2019;381(20):1918-1928. doi:10.1056/NEJMoa1816594
- Yazici, H et al.: Behçet syndrome: a contemporary view. Nat Rev Rheumatol 2018;14(2):107-119. doi:10.1038/nrrheum.2017.208
- Altenburg, A et al.: [Epidemiology and clinical aspects of Adamantiades-Behçet disease in Gemany. Current data]. Ophthalmologe
2012;109(6):531-41. doi:10.1007/s00347-012-2601-4
- Hatemi, G et al.: Developing a Core Set of Outcome Measures for Behçet Disease: Report from OMERACT 2016. J Rheumatol
2017;44(11):1750-1753. doi:10.3899/jrheum.161352
- Leccese, P et al.: Management of skin, mucosa and joint involvement of Behçet's syndrome: A systematic review for update of the EULAR recommendations for the management of Behçet's syndrome. Semin Arthritis Rheum 2019;48(4):752-762. doi:10.1016/j.semarthrit.2018.05.008
- Hatemi, G et al.: Efficacy of apremilast for oral ulcers associated with active Behcet's syndrome over 64 weeks: results from a phase III study. EULAR 2019. Abstract #OP0146 (Ann Rheum Dis 78(Suppl. 2):A148).
- Hatemi, G et al.: Apremilast for Behçet's syndrome--a phase 2, placebo-controlled study. N Engl J Med 2015;372(16):1510-8. doi:10.1056/NEJMoa1408684
- Senusi, AA et al.: Behçet's syndrome and health-related quality of life: influence of symptoms, lifestyle and employment status. Clin Exp Rheumatol 2017;35 Suppl 108(6):43-50
- Sadetsky, N et al.: Predictive value of serial measurements of quality of life on all-cause mortality in prostate cancer patients: data from CaPSURE (cancer of the prostate strategic urologic research endeavor) database. Qual Life Res 2009;18(8):1019-27. doi:10.1007/s11136-009-9526-7
- Tsai, SY et al.: Health-related quality of life as a predictor of mortality among community-dwelling older persons. Eur J Epidemiol 2007;22(1):19-26. doi:10.1007/s10654-006-9092-z
- Kroenke, CH et al.: Prospective change in health-related quality of life and subsequent mortality among middle-aged and older women. Am J Public Health 2008;98(11):2085-91. doi:10.2105/ajph.2007.114041
- Hatemi, G et al.: Improvements in Disease Activity and Quality of Life for up to 64 Weeks in Patients with Behçet’s Syndrome: Results from a Phase III Study. ACR 2019. Abstract #946 (Arthritis Rheumatol 2019;71(suppl 10)).
- Hatemi, G et al.: Apremilast for oral ulcers associated with active Behçet's syndrome over 68 weeks: long-term results from a phase 3 randomised clinical trial. Clin Exp Rheumatol 2021;39 Suppl 132(5):80-87
AUT-407-1122-80015



